

团队基于这一重大公共卫生问题,定量评估了当前KP耐药特征和毒力特点,梳理目前公开报道的噬菌体治疗案例。然而,当前噬菌体治疗因其易产生抗性和宿主范围狭窄的固有限制,阻碍了其在临床的深度推广和应用。针对这一难题,文章总结近年来快速发展的噬菌体基因编辑策略,包括同源重组(HR)、BRED/BRIP 技术、CRISPR-Cas系统及基因组重启(rebooting)工程,为突破噬菌体应用瓶颈提供了新思路与路径(图1)。该综述于 2025 年 2 月 3 日在线发表于 Microbiological Research(IF2024:6.9) DOI: 10.1016/j.biotechadv.2025.108689 .
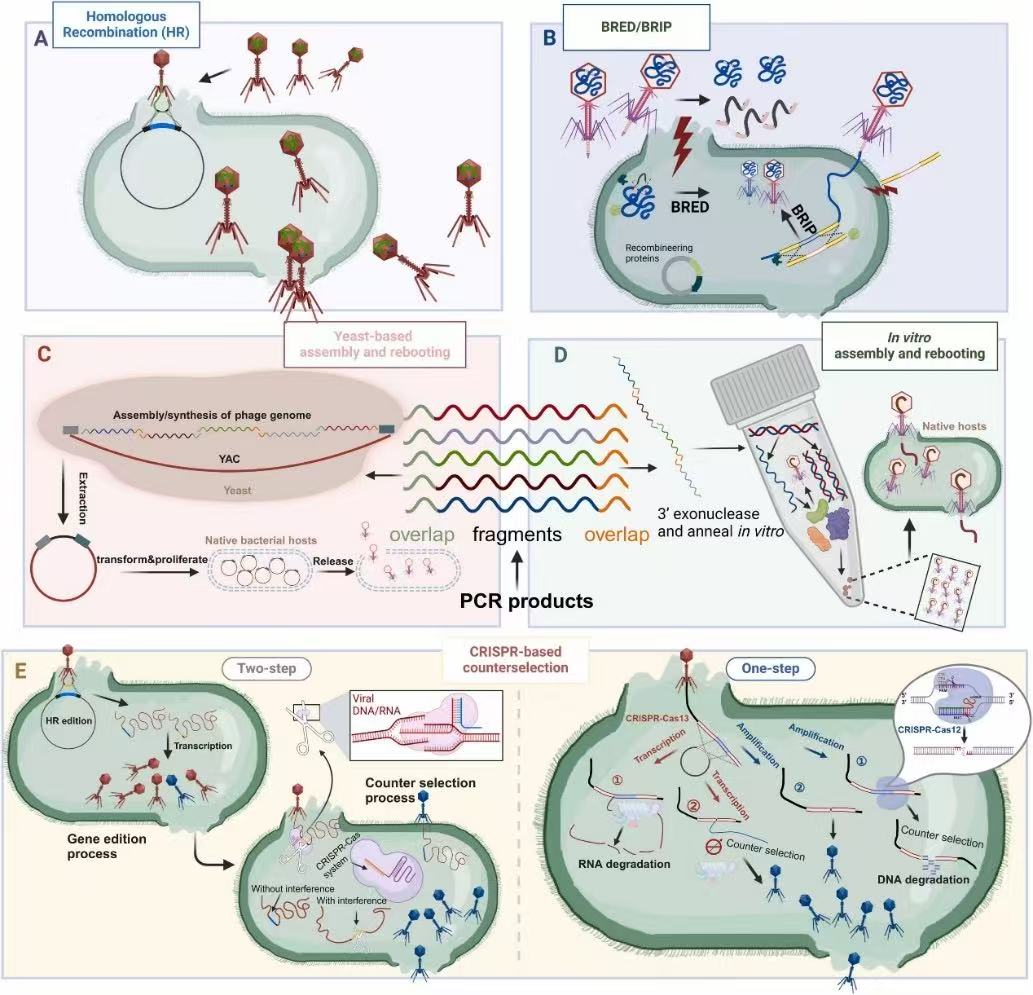
图1 噬菌体工程策略
基于上述进展,该团队继续聚焦噬菌体抗KP领域,重点针对KP噬菌体抗性产生机制和抑制策略展开专题综述。文章首先梳理了KP对噬菌体抗性的时空演化特征,指出受体阻断机制在现有研究中占据主导地位(图2)。提出两种假说:进化轨迹假说与研究偏见假说。前者认为,KP与噬菌体经历长期共进化可导致净化选择,使防御机制逐渐偏向受体修饰,并削弱其他防御体系;此背景下,受体阻断优势体现了真正的进化优化。以 CRISPR-Cas 抗性系统为例,尽管其存在于约三成KP基因组中,但临床上受体介导抗性仍占首位。这可能源于受体突变在数代细菌内即可实现快速逃逸,而 CRISPR 抗性则需要经历间隔子获取与功能表达等复杂过程。此外,CRISPR 系统存在并不等同于有效防御,部分系统可能因缺少关键组分或间隔子库陈旧而处于非活跃状态。故,其表面修饰更像是“第一道快速防线”,而 CRISPR 则可能承担长期适应性免疫的角色,这一区分对于理解临床环境中抗性动态具有重要意义。

图2 KP对抗噬菌体机制
研究抗性机制的同时,团队还系统总结了当前抑制噬菌体抗性的多种策略,包括序贯疗法与鸡尾酒疗法、噬菌体与抗生素或中药联合应用,及噬菌体纳米复合物等,为临床应用提供了多元化思路。最后,文章紧跟通用生物大语言模型的快速发展,展望了人工智能(AI)在噬菌体疗法中的潜在应用场景:如预测噬菌体生活方式(裂解型性或溶原性)、基于序列结果快速配型、模拟与优化噬菌体组合等,并进一步展望从头设计新型噬菌体基因组的研究前景及可行性。该综述于 2025 年 8 月 20 日在线发表于Biotechnology Advances(IF2024:12.5)。DOI : 10.1016/j.micres.2025.128083.
课题研究得到了河南省重大科技专项(省国际科技合作重点项目,241111521100),河南省科技攻关项目(252102111013)的资助。
课题研究得到了河南省重大科技专项(省国际科技合作重点项目,241111521100),河南省科技攻关项目(252102111013)的资助。
