
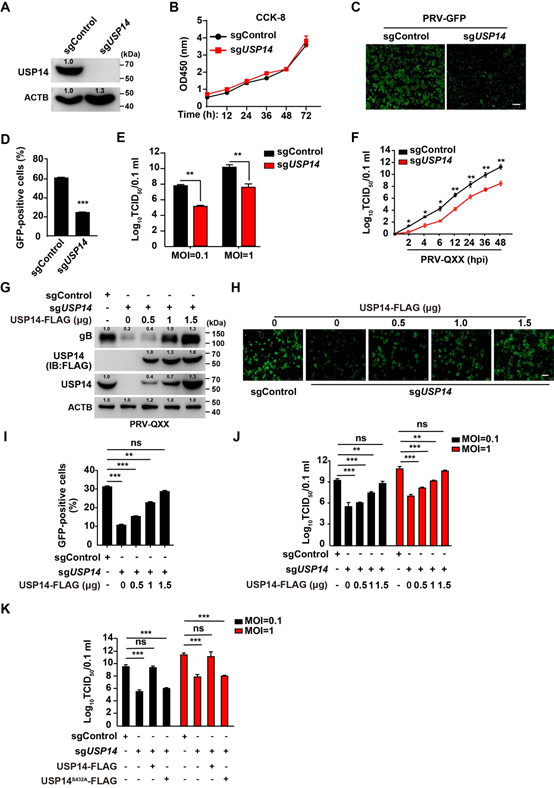
(图1 敲除USP14抑制PRV增殖)
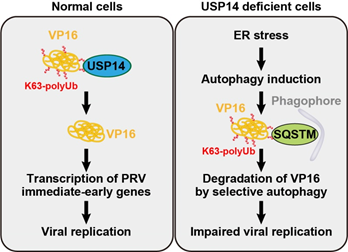
(图2 抑制USP14影响α 疱疹病毒复制模式图)
近日,我院褚贝贝教授团队在α疱疹病毒感染研究中取得重要进展,该研究发现USP14在感染早期与伪狂犬病毒 (pseudorabies virus, PRV) VP16蛋白结合后去泛素化VP16,确保病毒复制所需早期基因转录。抑制USP14能够促进ER stress引起的细胞自噬,进而通过SQSTM1/p62介导的选择性自噬途径降解。
疱疹病毒是具有囊膜的双链DNA病毒,分为α疱疹病毒、β疱疹病毒和γ疱疹病毒三个亚科。α疱疹病毒包括能够感染人的单纯疱疹病毒1/2型 (Herpes simplex virus type 1/2,HSV-1/2)、水痘带状疱疹病毒 (Varicella-zoster virus,VZV) 以及感染动物的伪狂犬病病毒 (Pseudorabies virus,PRV)、鸭病毒性肠炎病毒 (Duck enteritis virus, DEV)。α疱疹病宿主范围广,具有独特的潜伏-再活化感染机制。全世界超过37亿50岁以下的人感染HSV-1,4.17亿17至49岁的人感染HSV-2。全世界范围内至今还没有有效的α疱疹病毒疫苗。
泛素特异性蛋白酶 (Ubiquitin-specific proteases, USPs) 是去泛素化酶中最大的亚家族,在免疫和感染性疾病中发挥重要功能。为了研究USP在α疱疹病毒复制中的作用,作者评估了13种USP抑制剂对PRV复制的影响。结果显示13种USP抑制剂均可抑制PRV增殖,其中USP14抑制剂b-AP15的抑制效果最显著,同时敲除USP14也能抑制PRV增殖(图1)。
作者进一步解析了抑制 USP14影响PRV增殖的具体分子机制。研究结果表明, USP14在感染早期直接与参与PRV立即早期基因和早期基因转录的VP16被膜蛋白相互作用,使VP16去泛素化,从而稳定VP16有利于PRV复制。抑制 USP14促进VP16 的168位赖氨酸发生K63连接泛素化修饰和蛋白降解。然而此蛋白降解不依赖泛素-蛋白酶体系统,而依赖内质网应激引起的细胞自噬途径。泛素化VP16与选择性自噬受体分子SQSTM1结合后通过自噬溶酶体系统降解。此外,USP14抑制剂在小鼠体内具有较好的预防和治疗PRV 感染的效果。该研究阐明了抑制 USP14 激活 α 疱疹病毒 VP16 选择性自噬降解的分子机制,为治疗α疱疹病毒感染提供了新的药物靶标(图2)。
该研究成果以题为“Inhibition of USP14 influences alphaherpesvirus proliferation by degrading viral VP16 protein via ER stress-triggered selective autophagy” 的研究论文在线发表于国际著名期刊Autophagy。褚贝贝教授为通讯作者,我校基础兽医学明胜利、张爽博士和王棋硕士为本文共同第一作者。本研究得到了国家自然科学基金、河南省自然科学基金和河南农业大学杰出人才项目支持。
原文链接:https://www.tandfonline.com/doi/full/10.1080/15548627.2021.2002101
